zzgl. MwSt.
- Virtual Classroom-Preis: 616,55 € zzgl. MwSt.
- Dauer: 1 Tag (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 219.80 €
- Artikelnummer: S228
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Live Virtual-Classroom-Training - 04.07. - 04.07.25. Erwin Fredel
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 24.10. - 24.10.25. Erwin Fredel
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
Computergestützte Systeme und damit einhergehend die umfassende Software Validierung / Computer System Validierung in der Medizinprodukte Herstellung und Medizintechnik nimmt immer mehr an Bedeutung zu. Medizinprodukte oder Arzneimittel werden verstärkt mit Hilfe von Computer Systemen / Software entwickelt bzw. hergestellt - und diese müssen nationale sowie internationale gesetzliche und regulatorische Anforderungen erfüllen und vor ihrem ersten Einsatz validiert werden. Zur Computer System Validierung (Computerized Systems Validation - CSV) gibt es bewährte Standards sowie normative Grundlagen, die man berücksichtigen muss.
Wir zeigen Ihnen in diesem Seminar zur Computer System Validierung, wie Sie eine Softwarevalidierung norm- und gesetzeskonform durchführen! Dabei werden die EG-Richtlinien sowie die geltenden Normen berücksichtigt. Sie lernen die Forderungen der Norm EN ISO 13485 sowie der Food and Drug Administration - FDA (21 CFR 820) in Bezug auf die Software-Validierung kennen und wissen im Anschluss der Schulung, wie diese Anforderungen erfüllt werden und wie Sie Ihre Software lückenlos validieren können. Denn wird diese nicht oder nicht korrekt validiert, kann es zu Fehlfunktionen kommen, die eine Gefahr für die Qualität von Medizinprodukten darstellen können.
Idealerweise erfolgt der Validierungsansatz nach einem Lifecycle-Modell (V-Modell), welches in diesem Seminar zur Computer System Validierung ebenfalls erläutert wird. Zudem stellen wir Ihnen den Leitfaden GAMP 5 als Orientierung zur Validierung von computergestützten Systemen vor. GAMP steht für "Good Automated Manufacturing Practices" und beschreibt dabei mögliche Ansätze, mit denen der valide Zustand von computergestützten Systemen in der Medizinprodukte Industrie nachgewiesen werden kann. Somit sind Sie nach diesem Seminar zur Softwarevalidierung in der Lage, diese anhand strukturierter und standardisierter Prozesse in Ihrem Betrieb durchzuführen und die Erfüllung der regulatorischen und normativen Forderungen sicherzustellen!

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind die Inhalte in Ihrem Seminar zur Software Validierung?
Lernen Sie in nur einem Tag alles Wichtige rund um die Computer System Validierung in der Medizinprodukteindustrie und profitieren Sie dabei von dem reichem Erfahrungsschatz Ihres Trainers.
Normative Grundlagen zur Computer System Validierung
Zu Beginn stellt Ihr Trainer Ihnen die normativen Grundlagen vor.
- EN ISO 13485
- FDA 21 CFR 820
Durchführung der Computer System Validierung (CSV)
Weiter geht es in der Schulung mit der Durchführung der Software Validierung. Sie lernen alle Aspekte kennen und wissen anschließend, worauf Sie besonders achten müssen.
- Erstellung eines Validierungsplans
- Benutzeranforderungsspezifikation der Softwarevalidierung
- Risikoanalyse bei der Planung der Softwarevalidierung
- Funktionsanforderungsspezifikation
- Designanforderungsspezifikation
- Erstellung eines Testplans
- Der Abweichungsbericht
- Der Validierungsbericht
- Die Revalidierung
- Der Lebenszyklus eines computergestützten Systems
- Das V-Modell - Vorgehensweise als bei der Validierung
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach diesem Seminar zur Computer System Validierung (CSV)?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme an der Schulung zur Software-Validierung / Computer System Validierung in der Medizinprodukteindustrie in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Qualifikationsbescheinigung dokumentiert dabei die behandelten Inhalte sowie die Schulungsdauer und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.


Was ist das Ziel dieser Schulung zur Software...
Welche Zielgruppe sprechen wir mit diesem Seminar...
Voraussetzungen für die Teilnahme an diesem Seminar zur...
Was ist das Ziel dieser Schulung zur Software Validierung?
Sie lernen in diesem CSV Seminar zur Computer System Validierung, wie Sie standardisierte Prozesse in Ihrem Betrieb verankern, die die aktuellen regulatorischen Anforderungen zur Software Validierung - insbesondere gem. EN ISO 13485 sowie FDA 21 CFR 820 - in der Medizinprodukte Industrie erfüllen. So stellen Sie sicher, dass Ihre Computersysteme für produktions- und qualitätsrelevante Prozesse kontrolliert und validiert werden.
Welche Zielgruppe sprechen wir mit diesem Seminar an?
Dieses Seminar zur Computer-System-Validierung richtet sich an Fachkräfte und Beauftragte im Qualitätsmanagement, Verantwortliche für die Bereiche Produktion und Entwicklung von Medizinprodukten, Projektleiter, Führungskräfte mit Validierungsverantwortung, IT-Fachleute bei Herstellern von Medizinprodukten, Anbieter sowie Entwickler von IT-Systemen im medizinischen Bereich.
Voraussetzungen für die Teilnahme an diesem Seminar zur Computer System Validierung / Software Validierung
Es sind keine speziellen Voraussetzungen zur Teilnahme an dieser Schulung erforderlich.
Ihre Servicebausteine in diesem Software Validierung / Computer System Validierung (CSV) in der Medizinprodukteindustrie Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | Methoden zur Entscheidungsfindung und Entscheidungsanalyse - Wichtige Werkzeuge für einen qualifizierten Entscheidungsprozess Im Wert von 99,90 € |
|
| Vorlagen: | Schulungsunterlagen FMEA nach RPZ inkl. Formblatt FMEA Im Wert von 119,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
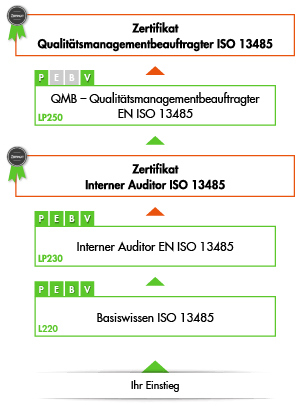
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Jede Schulung kann aber selbstverständlich auch unabhängig von der Gesamtausbildung einzeln besucht werden.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Schulungen rund um das Qualitätsmanagement in der Medizinprodukteindustrie
|
Seite 0 von 0
|