zzgl. MwSt.
- Virtual Classroom-Preis: 1.044,05 € zzgl. MwSt.
- Dauer: 2 Tage (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 399.80 €
- Artikelnummer: S227
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Live Virtual-Classroom-Training - 26.06. - 27.06.25. Bernd Stadter
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 13.11. - 14.11.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Pforzheim Parkhotel - 13.11. - 14.11.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
Die Prozessvalidierung im Bereich Medizinprodukte spielt bei nicht verifizierbaren Prozessen im Rahmen der Herstellung von Medizinprodukten eine große Rolle und wird sowohl von der Norm EN ISO 13485 als auch von der FDA Quality System Regulation 21 CFR 820 gefordert. Die Qualitätssicherung durch Inspektionen und Prüfungen alleine reicht häufig nicht aus oder führt zur Nichtkonformität des Produkts, da Medizinprodukte oftmals besonders komplex und sensibel sind. Sobald Sie Prozesse validieren weisen Sie nach, dass die Prozesse der Herstellung zum einen sicher und robust entwickelt wurden, zum anderen aber auch über die gesamte Dauer des Produktlebenszyklus zuverlässige Ergebnisse liefern werden.
Erfahren Sie am 1. Tag dieser Schulung zur Prozessvalidierung für Medizinprodukte, wie eine zielgerichtete Validierung von Prozessen durchgeführt wird! Die Basis der Schulung bilden die Vorgaben der EN ISO 13485 und der FDA Quality System Regulation 21 CFR8 20. Lernen Sie, was hinter der Prozessvalidierung Medizinprodukte steckt, über welche Begrifflichkeiten und Abkürzungen Sie "stolpern" könnten - wie bspw. OQ, IQ, PQ - und wie eine regelkonforme GDP Dokumentation aussehen muss. Zudem erfahren Sie in dieser Schulung, was Sie bei einer Stichprobenentnahme (Prozess-Monitoring) beachten müssen, um die wesentlichen Informationen als Output aus Ihrer Prozessvalidierung kontinuierlich zu bestätigen!
Am 2. Tag des Seminars findet ein Workshop zur Prozessvalidierung im Bereich Medizinprodukte statt. In diesem können Sie die praktische Durchführung einer sicheren, zielgerichteten und regelkonformen Validierung der Prozesse üben. Erarbeiten Sie dabei mit professioneller Unterstützung durch unsere Experten selbst geeignete Methoden, Validierungsmasterpläne und eine GDP konforme Nachweis- und Dokumentationsstruktur für die Validierung Ihrer Prozesse. So gewinnen Sie nach diesem Workshop an Sicherheit für die Durchführung der Prozessvalidierung in Ihrem eigenen Unternehmen und wissen, worauf Sie bei der Realisierung, der Dokumentation sowie der Auswertung achten müssen.

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind die Inhalte Ihrer Schulung zur Prozessvalidierung Medizinprodukte?
Sie lernen in diesem Seminar, wie Sie auf Basis der greifenden Normen und Vorgaben in der Medizinprodukteindustrie bei der Validierung von Prozessen vorgehen und welche gängigen Verfahren der Prozessvalidierung sich dabei in der Praxis bewährt haben. Dabei lernen Sie anhand konkreter Beispiele, wie Prozesse der Herstellung von Medizinprodukten normkonform validiert und dokumentiert werden.
Tag 1 - Grundlagen
Zunächst machen wir Sie mit den wesentlichen Grundlagen und den normativen und gesetzlichen Forderungen vertraut, auf deren Basis Prozesse validiert werden müssen.
- Grundlagen und Hintergründe der Validierung von Prozessen in der Medizinprodukteindustrie
- Aktuelle Forderungen zur Prozessvalidierung: EN ISO 13485 und 21 CFR 820 (FDA)
- Begrifflichkeiten - u.a. IQ - Installations Qualifizierung, OQ - Funktions Qualifizierung, PQ - Leistungs Qualifizierung
- Vorgaben zur Dokumentation
- Risikobasierte Stichprobenpläne auf Basis AQL und statistische Unterstützung
- Integration eines Risikomanagements
- Risiko- und Change Management in der Prozessvalidierung
Tag 2 - Workshop
Nun geht es an die praktische Umsetzung des Erlernten - wir versetzen Sie anhand eines Beispiels in die Lage, einen Prozess zielgerichtet zu validieren.
- Prozessvalidierung Medizinprodukte: Gemeinsame Erstellung eines Validierungsplans anhand eines konkreten Beispiels
- Beispiele für IQ und OQ Protokolle sowie wichtige Vorgaben zur Durchführung (Dokumentation, Messwerte, Rückverfolgbarkeit)
- Auswertung/ Bewertung von Ergebnissen und Erstellen eines Validierungsberichts
- Gezielte Hilfestellung durch unsere Experten und wichtige Tipps für die tägliche Praxis
Bitte beachten Sie:
- Es wird nicht behandelt, wie Sterilisations- sowie Reinigungsprozessen validiert werden.
- Die Bewertung bzw. Auswertung der Validierungsergebnisse durch statistische Verfahren wird nur am Rande behandelt.
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach diesem Seminar zur Prozessvalidierung?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme an der Schulung in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Qualifikationsbescheinigung dokumentiert dabei die behandelten Inhalte sowie die Schulungsdauer und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.


Was ist das Ziel dieser Schulung zur Prozessvalidierung...
Welche Zielgruppe sprechen wir mit diesem Seminar...
Voraussetzungen für die Teilnahme an dieser Schulung zur...
Was ist das Ziel dieser Schulung zur Prozessvalidierung für Medizinprodukte?
Sie erfahren in dieser Schulung, wie Sie auf Basis der greifenden Normen und Regularien in der Medizinprodukteindustrie bei der Validierung von Prozessen vorgehen und welche gängigen Modelle der Prozessvalidierung sich dabei in der Praxis bewährt haben! Sie erproben Ihr erworbenes Wissen zur Validierung von Prozessen in der Medizinprodukteindustrie direkt in der Praxis und lernen anhand von konkreten Beispielen, wie eine normkonforme Validierung für den Herstellungsprozess von Medizinprodukten durchgeführt und dokumentiert wird. Der Workshop am 2. Tag zeichnet sich durch seinen maximalen Praxistransfer aus gibt Ihnen die Möglichkeit, sich mit unserem Experten sowie mit den andern Teilnehmer austauschen und wichtige Erkenntnisse für die Umsetzung in Ihrem eigenen Unternehmen zu gewinnen.
Welche Zielgruppe sprechen wir mit diesem Seminar an?
Diese Grundlagen Schulung und Workshop zur Validierung von Prozessen in der Medizinprodukteindustrie richtet sich an Fachkräfte und Beauftragte im Qualitätsmanagement, Verantwortliche für die Bereiche Produktion und Entwicklung, Projektleiter, sowie Führungskräfte mit Validierungsverantwortung.
Voraussetzungen für die Teilnahme an dieser Schulung zur Prozessvalidierung für Medizinprodukte
Es sind keine speziellen Voraussetzungen zur Teilnahme an der Schulung erforderlich.
Ihre Servicebausteine in diesem Prozessvalidierung Medizinprodukte - Grundlagen Seminar und Workshop Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | Process Mapping - Geschäftsprozessanalyse erfolgreich umsetzen - E-Learning Im Wert von 149,90 € |
|
| Vorlagen: | Prozessmanagement und Geschäftsprozesse Vorlagenpaket - Prozesse, Kernprozesse, Prozesslandkarte - Ihr Prozess System erfolgreich gestalten Im Wert von 249,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
Im Bereich Qualitätsmanagement in der Medizinprodukteindustrie haben wir zahlreiche Schulungen sowie modulare Ausbildungsmöglichkeiten für Sie im Angebot. Bilden Sie sich jetzt umfassend in Ihrem persönlichen Themengebiet weiter! Nachfolgend haben wir einige Schulungsmöglichkeiten für Sie zusammen gestellt.
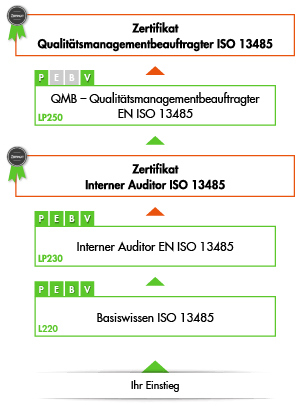
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Sie können aber selbstverständlich auch jede Schulung einzeln besuchen, unabhängig von der Gesamtausbildung.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Schulungen rund um das Qualitätsmanagement in der Medizinprodukteindustrie
Entdecken Sie auch unsere individuellen Seminare zu gezielten Themen und eignen Sie sich die erforderlichen Kenntnisse für die erfolgreiche Umsetzung in Ihrem eigenen Unternehmen an!
|
Seite 0 von 0
|