zzgl. MwSt.
- Virtual Classroom-Preis: 1.234,05 € zzgl. MwSt.
- Dauer: 3 Tage (von 09:00 - 17:00 Uhr)
- Servicebausteine: im Wert von 349.70 €
- Zertifikat: inkl. Prüfung im Wert von 249.90 €
- Artikelnummer: LP250
- Max. Teilnehmer: 15
- Kursform: Präsenz oder Virtual Classroom
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Nächste Termine:
Düsseldorf NH Hotel City Nord - 02.07. - 04.07.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 02.07. - 04.07.25. Oliver Kirn
![Jetzt diesen Termin buchen!]()
Live Virtual-Classroom-Training - 12.11. - 14.11.25. Bernd Stadter
![Jetzt diesen Termin buchen!]()
Frankfurt NH Hotel Airport - 12.11. - 14.11.25. Bernd Stadter
![Jetzt diesen Termin buchen!]()
Alle Termine anzeigen
-
-
Weitere Kursformate:
In der Qualitätsmanagementbeauftragter ISO 13485 Ausbildung lernen Sie die Aufgaben als QMB für Medizinprodukte kennen und umzusetzen. Erweitern Sie dabei Ihr Wissen über die Qualitätsmanagement Grundlagen im Bereich Medizinprodukte um alle Kompetenzen, die Sie für die anschließende Umsetzung der Aufgaben als QMB für Medizinprodukte benötigen und qualifizieren Sie sich somit zum zentralen Ansprechpartner rund um das QMS in Ihrem Unternehmen. Dabei sind Sie nicht nur der interne Ansprechpartner für Mitarbeiter und die oberste Leitung in Ihrem Unternehmen, sondern sind ebenfalls für externe Stellen, wie Zertifizierungsstellen / Benannte Stellen oder zuständigen Behörden, der erste Kontakt. Diesen Stellen müssen Sie als QMB ISO 13485 ein funktionierendes QM-System nachweisen, welches unter Berücksichtigung der normativen und regulatorischen Anforderungen sichere Medizinprodukte zum Ergebnis hat.
Kurz gesagt sind Sie als Qualitätsmanagementbeauftragter ISO 13485 für die Einführung (wenn nicht bereits geschehen), die Realisierung, die Weiterentwicklung und Aufrechterhaltung sowie die ständige Überwachung des QM-Systems und den damit einhergehenden erforderlichen Prozessen in Ihrem Unternehmen verantwortlich. Zusätzlich unterliegen Sie als QMB für Medizinprodukte Berichtspflichten gegenüber der obersten Leitung und müssen das Bewusstsein über die Kundenanforderungen in der gesamten Organisation stärken. Lernen Sie in dieser Schulung in nur 3 Tagen, wie Sie Ihrer Rolle als Qualitätsmanagementbeauftragter ISO 13485 gerecht werden! Ihre Trainer verfügen über jahrelange Erfahrung beim Aufbau, der Einführung und Aufrechterhaltung von Qualitätsmanagementsystemen in der Medizinprodukteindustrie und können somit aus einem breiten Erkenntnisschatz schöpfen, um Ihre individuellen Fragen in der Schulung zu beantworten und Ihnen praktische Hilfestellung zu leisten!

Kostenlos für Sie: Prozessbeschreibung Vorlage kostenlos - Prozessbeschreibung erstellen - Erfinden Sie das Rad nicht neu! Die Nutzung beinhaltet keine Folgeverpflichtungen, kein Abo und bedarf keiner Kündigung in irgendeiner Form! Details >
Was sind Ihre Inhalte der Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485?
In dieser Ausbildung qualifizieren wir Sie zum Qualitätsmanagementbeauftragten ISO 13485. Sie lernen, wie Sie Ihr QM-System in der Medizinprodukteindustrie norm- und rechtssicher aufbauen, betreuen und kontinuierlich weiterentwickeln. Zudem zeigen wir Ihnen, wie Sie Ihrer Berichtspflicht gegenüber der obersten Leitung , Behörden und Zertifizierungsstellen / Benannten Stellen nachkommen.
Welche Aufgaben und Kompetenzen hat ein Qualitätsmanagementbeauftragter ISO 13485?
Zuerst zeigt Ihnen Ihr Trainer, welche Aufgaben ein Qualitätsmanagementbeauftragter ISO 13485 in der Medizinproduktebranche erfüllt und welche Kompetenzen hierfür benötigt werden.
- Übung: Anforderungen an die Position des QMB Medizinprodukte anhand eines Fallbeispiels selbst erarbeiten
- Der QMB ISO 13485 und seine Aufgaben im Unternehmen
- Berichtspflichten gegenüber der obersten Leitung
- Das Identifizieren und Erfüllen der regulatorischen Anforderungen
- Der QMB ISO 13485 als Sicherheitsbeauftragter
- Ergebnisdiskussion
Implementierung eines QM-Systems und dessen Anforderungen, auch für die Produkte
Sie lernen in dieser Einheit Ihrer Ausbildung, wie Sie zur Einführung eines QM-Systems in der Medizinprodukteindustrie vorgehen und wie Sie die normativen und regulatorischen Anforderungen erarbeiten sowie umsetzen können. Dabei zeigen wir ihnen auch, was Sie bei der technischen Dokumentation und der Klassifizierung von Medizinprodukten beachten müssen.
- Vorgehen bei der Einführung
- Projektplanung
- Praxisgerechte Umsetzung normativer sowie regulatorischer Anforderungen inkl. Risikomanagement
- Produktklassifizierung und daraus abgeleitet das korrekte Konformitätsbewertungsverfahren
- Technische Dokumentation
- Kombinationsprodukte und Konsultationsverfahren
- Überprüfung der wirksamen Einführung und Aufrechterhaltung durch interne Audits
Welche rechtlichen Aspekte müssen Sie im Qualitätsmanagement bei Medizinprodukten beachten?
Rechtliche Aspekte spielen im Qualitätsmanagement für Medizinprodukte eine besonders große Rolle. Hierin müssen Sie sich als Qualitätsmanagementbeauftragter ISO 13485 entsprechend gut auskennen, Ihr Trainer erläutert Ihnen die wichtigsten Aspekte.
- Registrierung von Medizinprodukten (nach DIMDI unter den anwendbaren Richtlinien)
- Zuständige Behörden im In- und Ausland kennen
- Benannte Stellen - Tätigkeit, Kompetenz
- Zertifizierung im gesetzlich geregelten Bereich
- Audits (angekündigt sowie unangekündigt)
- Ausstellung von Bescheinigungen (CE-Zertifikat)
- Qualitätssicherungsvereinbarungen (QSV) mit kritischen Lieferanten
- Risikomanagementakte
- Sicherheitsbeauftragter
- Medizinprodukteberater
Qualitätsorientierung: Interne Audits, Managementbewertung und Qualitätswerkzeuge
Die Bereiche Audit, Managementbewertung sowie Anwendung von Qualitätswerkzeugen sind feste Bestandteile Ihrer Kompetenzen als QMB. In Ihrer Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485 lernen Sie diese Bereiche durch Praxisübungen ausführlich kennen.
- Pflicht zur Selbstbewertung (Feststellung der Konformität) durch interne Audits und Managementbewertung; Messung, Analyse und Verbesserung
- Praxisübung: Optimierung der Audit-Organisation
- Praxisübung: Vorbereiten der Managementbewertung
- Praxisübung: Erstellung eines Prozesses für Korrektur- und Vorbeugemaßnahmen
Regulatorische Anforderungen
Die regulatorischen Anforderungen an Ihr QM-System gemäß DIN EN ISO 13485 erarbeiten sich die Schulungsteilnehmer in einer Projektarbeit, unter Anleitung sowie mit Unterstützung des Referenten.
- Projektarbeit: Verankerung der Regulatorischen Anforderungen im QM-System
Führungs- und Sozialkompetenz als Qualitätsmanagementbeauftragter ISO 13485
Als QMB müssen Sie neben der rein fachlichen Kompetenz ebenfalls den Bereich Führungs- und Sozialkompetenz erfüllen. Hierzu lernen abschließend mehr zu den Motivatoren des QM-Beauftragten sowie der Mitarbeiter im Unternehmen.
- Praxisübung: Erkennen der eigenen Motivatoren
- Handlungsfelder als Qualitätsmanagementbeauftragter für Medizinprodukte im Bereich der Mitarbeitermotivation (z.B. Mitarbeiter zur gewissenhaften Erstellung und Überarbeitung von Prozessbeschreibungen motivieren, das Einhalten der vorgegebenen Abläufe einfordern)
Schriftliche Prüfung zur Qualifizierung zum QMB für Medizinprodukte
Am Ende des 3. Tages findet eine Abschlussprüfung zum Erhalt des Zertifikats "Qualitätsmanagementbeauftragter DIN EN ISO 13485" statt. Der Austausch mit Gleichgesinnten in dieser Schulung QMB für Medizinprodukte erweitert zusätzlich auf unschätzbare Weise Ihren Erfahrungsschatz und gibt Ihnen neue Impulse für Ihre Aufgaben als Qualitätsmanagementbeauftragter ISO 13485.
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach dieser Ausbildung zum QMB für Medizinprodukte?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme an der Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485 in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Qualifikationsbescheinigung dokumentiert dabei die behandelten Inhalte sowie die Schulungsdauer und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.
Nach bestandener Prüfung am Ende der Ausbildung erhalten Sie das VOREST Zertifikat "Qualitätsmanagementbeauftragter DIN EN ISO 13485" ebenfalls in Deutsch sowie in Englisch. Das Zertifikat bescheinigt Ihnen den qualifizierten Abschluss der Ausbildung und bestätigt nach erfolgreichem Leistungsnachweis Ihre Kompetenzen.




Prüfungsinhalte
Die Prüfung bezieht sich inhaltlich auf die VOREST Schulungen "Basiswissen ISO 13485", "Interner Auditor ISO 13485" sowie "Qualitätsmanagementbeauftragter DIN EN ISO 13485".
Prüfungszulassung
Vorhandene Grundkenntnisse im Qualitätsmanagement gemäß ISO 13485 und internen Audits, siehe Voraussetzungen sowie die Teilnahme an der Qualitätsmanagementbeauftragter ISO 13485 Schulung.
Prüfungsabnahme am Ende Ihrer Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Die Abnahme der Prüfung sowie die Erstellung des Zertifikats erfolgt durch die Personalzertifizierungsstelle (PZS) der VOREST AG.
Wenn Sie sich für ein Präsenztraining entscheiden, erfolgt die schriftliche Prüfung am Ende des letzten Schulungstages Ihrer Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485. Nach Abschluss geht Ihre Prüfung zurück an die PZS der VOREST AG und wird von dieser korrigiert. Bei Bestehen erhalten Sie innerhalb von 2 Wochen Ihr deutsch- und englischsprachiges Zertifikat eingerahmt per Post.
Findet Ihre Ausbildung als Virtual-Classroom-Training statt, erfolgt die Prüfung am letzten Schulungstag online auf unserer E-Learning-Plattform. Die Online-Prüfung wird Ihnen im Laufe des letzten Schulungstages individuell freigeschaltet, das Passwort zur E-Learning Plattform erhalten Sie bereits durch die Freischaltung des optionalen E-Learnings vorab zur Schulung. Um Ihnen vorab einen Einblick in den Ablauf und die Bedienung Ihrer Online-Prüfung zu geben, erhalten Sie von uns Zugang zu einer Test-Prüfung. Diese ist optional und kein Bestandteil der Ausbildung. Nach Abschluss Ihrer Online-Prüfung wird diese automatisiert kontrolliert und das Ergebnis an die PZS der VOREST AG weitergeleitet. Auch beim Virtual-Classroom-Training erhalten Sie bei bestandener Online-Prüfung innerhalb von 2 Wochen Ihr deutsch- und englischsprachiges Zertifikat eingerahmt per Post.
Eine Wiederholung der Prüfung ist zu einem späteren Zeitpunkt möglich.
Was ist das Ziel dieser Ausbildung zum...
Welche Zielgruppe sprechen wir mit diesem Kurs an?Diese...
Voraussetzungen für die Teilnahme an dieser Ausbildung...
Was ist das Ziel dieser Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485?
Ziel dieser Schulung ist es, Ihnen die fachlichen Kompetenzen sowie die notwendigen Soft Skills zu vermitteln, damit Sie anschließend die Aufgaben eines QMB für Medizinprodukte gemäß DIN EN ISO 13485 umsetzen können. Dabei vervollständigen Sie Ihre Kenntnisse für ein erfolgreich funktionierendes Qualitätsmanagementsystem und erfahren weiterhin, wie Sie die ISO 13485 unternehmensspezifisch sowie regulatorisch und normativ konform umsetzen können.
Welche Zielgruppe sprechen wir mit diesem Kurs an?
Diese QMB ISO 13485 Weiterbildung richtet sich dabei an (zukünftige) Qualitätsmanagementbeauftragte, Qualitätsbeauftragte, Qualitätsmanager, QM-Auditoren, Qualitätsleiter sowie Sicherheitsbeauftragte gemäß MPG.
Voraussetzungen für die Teilnahme an dieser Ausbildung zum QMB für Medizinprodukte
Grundkenntnisse im Qualitätsmanagement, der Norm ISO 13485, anwendbarer regulatorischer Anforderungen für Medizinprodukte, Risikomanagement und internen Audits, z.B. analog den Schulungen "Basiswissen DIN EN ISO 13485" und "Interner Auditor DIN EN ISO 13485", werden in dieser Weiterbildung zum QMB für Medizinprodukte vorausgesetzt. Ein Nachweis ist diesbezüglich nicht zu erbringen. Die Buchung kann direkt vorgenommen werden.
Ihre Servicebausteine in diesem Qualitätsmanagementbeauftragter ISO 13485 - QMB Medizinprodukte Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| E-Kurs: | Die Q7 Qualitätswerkzeuge im Qualitätsmanagement online Schulung Im Wert von 149,90 € |
|
| E-Kurs: | Jahresplan - Ihre jährlichen Aufgaben als Qualitätsmanagementbeauftragter ISO 13485 für Medizinprodukte Im Wert von 99,90 € |
|
| Vorlagen: | KVP Startpaket - alle Vorlagen zur KVP Einführung Im Wert von 99,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
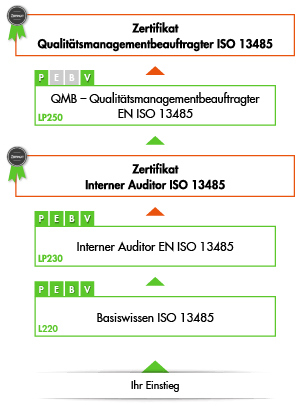
Die Qualitätsmanagementbeauftragter ISO 13485 Schulung ist Teil des modularen Ausbildungsprogramms der VOREST AG im Bereich Medizinprodukte. Sie ist dabei der dritte von drei Ausbildungsschritten hin zur Prüfung zum international anerkannten QMB ISO 13485. Jede ISO 13485 Schulung kann aber selbstverständlich auch unabhängig von der Gesamtausbildung einzeln besucht werden.
1. Schritt: Basiswissen Qualitätsmanagement Medizinprodukte DIN EN ISO 13485
2. Schritt: Interner Auditor DIN EN ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485 - QMB Medizinprodukte
Alle Schulungen und Qualifizierungsabschlüsse der VOREST AG sind national und international anerkannt. Die VOREST AG ist akkreditierter Personalzertifizierer, was Ihnen die Sicherheit gibt, eine wertvolle Ausbildung zu erhalten.
|
Seite 0 von 0
|