zzgl. MwSt.
- Demo: Hier kostenlos reinschauen
- Dauer: 8.0 Stunden
- Nutzung: 2 Monate
- Servicebausteine: im Wert von 74.80 €
- Artikelnummer: SE232
- Kursform: E-Learning
- Seminarinfo: PDF-Download
- Inhouse: Ihre unverbindliche Anfrage
-
Weitere Kursformate:
Diese Online Schulung zur Entwicklung von Medizinprodukten behandelt die Umsetzung normativer und regulatorischer Anforderungen gemäß Abschnitt 7.3 der ISO 13485 sowie der Verordnung MDR 2017/745/EU. Der Entwicklungsprozess ist entscheidend für die Zulassung von Medizinprodukten. Neben dem Medizinprodukterecht müssen auch weitere regulatorische und normative Anforderungen berücksichtigt werden. In diesem Kurs lernen Sie, woher diese Anforderungen stammen und wie Sie die Umsetzung der Anforderungen angehen können.
In unserem Online Seminar vermittelt Ihnen Ihr Trainer das Wesentliche zur Medizinprodukte Entwicklung und gibt Ihnen Anregungen zur Umsetzung mit auf den Weg. Sie erwerben dabei Kenntnisse über die grundlegenden Sicherheits- und Leistungsanforderungen der MDR. Darüber hinaus erfahren Sie, welche Nachweise erforderlich sind und worauf Sie bei der Entwicklung von Medizinprodukten achten müssen. Abschließend wissen Sie, worauf Sie bei der Erstellung der für den Entwicklungsprozess erforderlichen Dokumentation achten müssen, um die allgemeinen Sicherheits- und Leistungsanforderungen zu erfüllen.
Kursdemo: Hier zum Live-Demokurs per Klick!
Sie möchten vor der Buchung einen Einblick in den E-Learning Kurs erhalten? Kein Problem! Hier können Sie sich einige Ausschnitte des Kurses anschauen - natürlich unverbindlich und ohne Anmeldung!
Was sind die Inhalte Ihrer Online Schulung zur Entwicklung von Medizinprodukten?
Dieses Online Schulung zeigt Ihnen alles Wichtige zur Umsetzung der regulatorischen sowie normativen Vorgaben im Rahmen des Entwicklungsprozesses von Medizinprodukten. Anhand von Übungen und Praxistransferen können Sie das erlernte Wissen direkt anwenden.
Regulatorischer sowie normativer Hintergrund
Zunächst erhalten Sie in der E-Learning Schulung einen Überblick über den regulatorischen und normativen Kontext, welcher die Grundlagen für die Entwicklung vom Medizinprodukten bildet.
- Hierarchie der Rechtsvorschriften in der EU
- Der Weg der Zulassung eines Medizinprodukts
- Umsetzung regulatorischer Anforderungen
Entwicklungsplanung und -eingaben sowie Entwicklungsergebnisse und -bewertung
Die beiden nachfolgenden Kapitel dieser Online Schulung bringen Ihnen die Anforderungen an die Erstellung eines Entwicklungsplans, die Bedeutung der Entwicklungseingaben, die Entwicklungsergebnisse sowie -bewertung. Der Entwicklungsplan legt den strukturierten Prozess fest, um alle Phasen der Produktentwicklung methodisch und regulatorisch konform zu gestalten. Mithilfe der Die Entwicklungseingaben definieren Sie die Anforderungen und Spezifikationen des Medizinprodukts. Die Entwicklungsergebnisse dokumentieren die technischen Lösungen und Produktspezifikationen, die aus den Entwicklungseingaben abgeleitet wurden. Ebenso zeigen sie, dass das Produktdesign diese Anforderungen erfüllt. Die Entwicklungsbewertung bewertet kontinuierlich den Fortschritt und die Ergebnisse, um sicherzustellen, dass die Produktanforderungen und Spezifikationen erfüllt werden.
- Medizinprodukte Entwicklung gemäß ISO 13485
- Abschnitt 7.3.2 - Entwicklungsplanung
- Abschnitt 7.3.3 - Entwicklungseingaben
- Vorstellung Beispielunternehmen
- Die medizinische Zweckbestimmung
- User Needs und Entwicklungseingaben
- Anforderungen an das Medizinprodukt formulieren
- Abschnitt 7.3.4 - Entwicklungsergebnisse
- Praxistransfer: Beispiele für Entwicklungsergebnisse
- Abschnitt 7.3.5 Entwicklugnsbewertung
- Tipps und Tricks: Erfolgsfaktoren für die Entwicklungsbewertung
- Praxistransfer: Bewertung der Entwicklungseingaben
- Praxistransfer: Enwicklungsbewertung für Design und Process Freeze
Verifizierung, Validierung und Design Transfer
In diesem Kapitel der Online Schulung zur Entwicklung von Medizinprodukten machen wir Sie mit der Entwicklungsverifizierung, -validierung sowie die Übertragung in die Produktion vertraut. Die Entwicklungsverifizierung stellt dabei sicher, dass das Produktdesign die festgelegten Anforderungen und Spezifikationen erfüllt. Die Entwicklungsvalidierung bestätigt, dass das fertige Produkt zuverlässig und sicher funktioniert. Mit dem Design Transfer erfolgt anschließend die Übergabe des validierten Designs an die Fertigung. Ziel ist es dabei, dass das Medizinprodukt konsistent und in Übereinstimmung mit den Spezifikationen hergestellt wird.
- Abschnitte 7.3.6 - Entwickungsverifizierung
- Beispiele für Entwicklungstätigkeiten
- Abschnitt 7.3.7 - Entwicklungsvalidierung
- Sinn und Zweck der klinischen Bewertung sowie der klinischen Prüfung
- Gebrauchstauglichkeit von Medizinprodukten nach DIN EN 62366
- Rückverfolgbarkeit im Entwicklungsprozess
- Abschnitt 7.3.8 - Übertragung der Entwicklung
- Praxistransfer: Identifizierung wichtiger Punkte für den Design Transfer
Technische Dokumentation und Lenkung von Entwicklungsänderungen
Im abschließenden Kapitel der Online Schulung zur Entwicklung von Medizinprodukten behandeln wir die Lenkung von Entwicklungsänderungen sowie die technische Dokumentation.
- Abschnitt 7.3.9 - Lenkung von Entwicklungsänderungen
- Hinweise zum Änderungsmanagement
- Ursachen für Entwicklungsänderungen
- Abschnitt 7.3.10 - Entwicklungsakten
Welches Zertifikat und welche Qualifikationsbescheinigung erhalten Sie nach der E-Learning Schulung?
Sie erhalten eine Qualifikationsbescheinigung zur Teilnahme an dem E-Learning Seminar zur Entwicklung von Medizinprodukten in Deutsch sowie in Englisch. Die englische Qualifikationsbescheinigung ist dabei als Serviceleistung im Preis enthalten. Die Qualifikationsbescheinigung dokumentiert dabei die behandelten Inhalte sowie die Schulungsdauer und dient Ihnen als Nachweis Ihrer Teilnahme an der Schulung.


Was ist das Ziel dieser Online Schulung zur Entwicklung von...
Welche Zielgruppe sprechen wir mit diesem Kurs an?Das...
Voraussetzungen für die Teilnahme an dieser Online...
Was ist das Ziel dieser Online Schulung zur Entwicklung von Medizinprodukten?
Diese E-Learning Schulung vermittelt Ihnen ein Verständnis der regulatorischen sowie normativen Anforderungen, die für die Medizinprodukte Entwicklung wichtig sind. Praktische Bespiele unterstützen die anschließende Umsetzung, sodass Sie die Dokumentation im Entwicklungsprozess von Medizinprodukten umsetzen können.
Welche Zielgruppe sprechen wir mit diesem Kurs an?
Das Online Seminar richtet sich dabei an alle Personen, die in Unternehmen an der Entwicklung für Medizinprodukte mitwirken oder dafür verantwortlich sind. Hierzu zählen Entwicklung, QM-Beauftragte, Produktmanager, verantwortliche Personen nach Art. 15 MDR
Voraussetzungen für die Teilnahme an dieser Online Schulung zur Entwicklung von Medizinprodukten
Für die Teilnahme an diesem E-Learning Seminar sollten Sie Grundkenntnisse zur ISO 13485 und der MDR (z.B. analog unserer Online Schulung Basiswissen ISO 13485 oder der MDR Schulung) mitbringen.
Technische Info
Für einen reibungslosen Ablauf des Kurses sind eine schnelle und stabile Internetverbindung, sowie ein aktueller und HTML5-fähiger Browser (Edge, Firefox oder Chrome) notwendig.
Die Dauer des Kurses beträgt 8 Stunden. Ihr individuelles Lerntempo kann dabei zu einer kürzeren oder längeren Kursdauer führen. Der E-Learning Kurs kann jeder Zeit pausiert werden - Ihr persönlicher Fortschritt wird gespeichert. Der Zugriff auf diesen E-Learning Kurs ist auf 2 Monate nach dessen Freischaltung beschränkt. Während dieser Zeit können Sie den Kurs so oft wiederholen, wie Sie möchten. Für die dauerhafte Nutzung erhalten Sie die vollständigen Unterlagen des E-Learning Kurses als E-Book.
Ihre Servicebausteine in diesem Online Schulung Entwicklung von Medizinprodukten nach ISO 13485 und MDR 2017/745 Kurs:
Als Kursteilnehmer erhalten Sie folgende Servicebausteine im Rahmen Ihrer Kursteilnahme. Diese Bausteine sind im Seminarpreis bereits enthalten und unterstützen Sie mit zusätzlichen Inhalten und Musterdokumenten zu Ihrem Kursthema. Den monatlichen Expertenbrief erhalten Sie erstmalig im Anschluss an Ihre Teilnahme. Dieser informiert Sie monatlich über aktuelle Fachinfos zu Ihrem Kursthema.
| Vorlagen: | Checkliste Übertragung der Entwicklung - Design Transfer Plan - Report Im Wert von 49,90 € |
|
| Vorlagen: | MDR 2020 - Leitfaden zur Umsetzung der EU Medizinprodukteverordnung MDR 2017/745/EU Im Wert von 24,90 € |
|
| Fachinfo: | Ihr monatlicher Expertenbrief Exklusive Expertentipps und Fachwissen für Sie |
Weitere mögliche Schritte Ihrer Ausbildung
ImQualitätsmanagement in der Medizinprodukteindustrie haben wir verschiedene Online Schulungen und Ausbildungsmöglichkeiten für Sie im Angebot. Bilden Sie sich jetzt umfassend in Ihrem persönlichen Themengebiet weiter! Nachfolgend haben wir einige Schulungsmöglichkeiten für Sie zusammen gestellt.
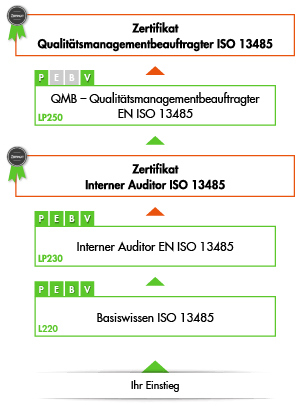
Ausbildung zum Qualitätsmanagementbeauftragten ISO 13485
Diese Ausbildung besteht aus drei Ausbildungsschritten bis hin zur Prüfung zum international anerkannten "Qualitätsmanagementbeauftragten ISO 13485". Sie können aber selbstverständlich auch jede Schulung einzeln besuchen, unabhängig von der Gesamtausbildung.
1. Schritt: Basiswissen Qualitätsmanagement ISO 13485
2. Schritt: Interner Auditor ISO 13485
3. Schritt: Qualitätsmanagementbeauftragter ISO 13485
Weiterbildungen gemäß der EU Medizinprodukte Verordnung - MDR 2017/745
Entdecken Sie weitere thematisch passende Schulungen rund um MDR und setzen Sie die Anforderungen erfolgreich in Ihrem Unternehmen um.
- Die aktuelle EU Medizinprodukte Verordnung - MDR 2017/745
- Medizinprodukte Vigilanz & Post Market Surveillance gemäß MDR 2017/745
- Technische Dokumentation für Medizinprodukte gemäß MDR 2017/745
- UDI Kennzeichnung für Medizinprodukte und grundlegende Sicherheits- und Leistungsanforderungen (GSPR)
- Medizinprodukte Händler und Importeure - Pflichten gemäß MDR Artikel 14 & 13
- ISO 14971 Risikomanagement für Medizinprodukte gemäß MDR 2017/745
- Online Schulung Verantwortliche Person MDR Artikel 15
- Schulung zum Medizinprodukteberater nach § 83 MPDG