Die ISO 13485 Zertifizierung weist nach, dass ein Unternehmen die Anforderungen der Norm an ein Qualitätsmanagement für Medizinprodukte erfüllt. Diese Norm ist speziell für die Medizintechnikindustrie entwickelt worden und definiert die Anforderungen an das Qualitätsmanagementsystem eines Unternehmens. Sie legt den Fokus auf die Sicherheit und Leistungsfähigkeit von Medizinprodukten über den gesamten Lebenszyklus - von der Produktentwicklung über die Produktion bis hin zur Nachbetreuung. Die ISO 13485 basiert dabei auf der allgemeinen ISO 9001. Sie geht jedoch in Bezug auf regulatorische Anforderungen und die Produktdokumentation deutlich weiter. In einer Branche, in der das Vertrauen der Kunden sowie die Einhaltung gesetzlicher Vorgaben sehr bedeutsam sind, bietet die ISO 13485 Zertifizierung eine wertvolle Grundlage, um die hohen Standards für die Herstellung von Medizinprodukten einzuhalten und sich somit auf eine Zertifizierung durch eine benannte Stelle vorzubereiten.
Auf dieser Seite möchten wir Ihnen die wichtigsten Aspekte der ISO 13485 Zertifizierung näherbringen. Sie erfahren, welche Vorteile die Zertifizierung mit sich bringt, wie der gesamte Ablauf aussieht und welche Kosten auf Sie zukommen können. Egal, ob Sie bereits in der Medizintechnik tätig sind oder sich gerade erst orientieren - unser Leitfaden bietet Ihnen die nötigen Informationen, um informierte Entscheidungen zu treffen und den Weg zur Zertifizierung erfolgreich zu meistern.
Wie lautet die Definition einer Zertifizierung?
Die DIN EN ISO/IEC 17000 beschreibt eine Zertifizierung als „Maßnahme durch einen unparteiischen Dritten, die aufzeigt, dass ein angemessenes Vertrauen besteht, dass ein ordnungsgemäß bezeichnetes Erzeugnis, Verfahren oder eine ordnungsgemäß bezeichnete Dienstleistung in Übereinstimmung mit einer bestimmten Norm oder einem bestimmten anderen normativen Dokument ist.“
Welche Vorteile bietet die ISO 13485 Zertifizierung für Ihr Unternehmen?
Die ISO 13485 Zertifizierung bietet zahlreiche Vorteile für Unternehmen sowie Organisationen, die Medizinprodukte entwickeln und herstellen. Zu den wichtigsten Vorteilen zählen:
- Erfüllung regulatorischer Anforderungen: Viele Länder, wie die EU und die USA, verlangen die ISO 13485 als Voraussetzung für die Marktzulassung von Medizinprodukten.
- Verbesserte Prozessqualität: Die Norm hilft Ihnen, Ihre internen Abläufe zu standardisieren und zu optimieren, was zu einer erhöhten Effizienz und Fehlervermeidung führt.
- Höheres Vertrauen bei Kunden und Partnern: Eine ISO 13485 Zertifizierung zeigt Ihren Kunden, dass Sie höchste Qualitäts- und Sicherheitsstandards einhalten.
- Wettbewerbsvorteil: Unternehmen mit einer ISO 13485 Zertifizierung heben sich von der Konkurrenz ab und sind in der Lage, auf internationalen Märkten Fuß zu fassen.
- Risiko- und Haftungsminimierung: Durch die strikte Einhaltung der Normenanforderungen können potenzielle Risiken in Ihren Produkten frühzeitig erkannt und somit minimiert werden. Dies führt zu einer geringeren Haftungswahrscheinlichkeit.

Weitere passende Blogbeiträge zum Thema:
Entdecken Sie auch unsere anderen Blogbeiträge zum Qualitätsmanagement für Medizinprodukte oder zum Audit und erhalten Sie Expertenwissen unter anderem zu diesen Themen:
Diese Voraussetzungen müssen Sie für eine ISO 13485 Zertifizierung erfüllen
Um eine ISO 13485 Zertifizierung zu erlangen, gibt es einige wesentliche Voraussetzungen, die Unternehmen erfüllen müssen. Der erste Schritt besteht darin, ein Qualitätsmanagementsystem (QMS) einzurichten, das auf die speziellen Anforderungen dieser Norm zugeschnitten ist. Dies bedeutet, dass alle relevanten Prozesse gut dokumentiert sein müssen, um sicherzustellen, dass jeder Mitarbeiter weiß, was von ihm erwartet wird. Verantwortlichkeiten sind klar zu definieren und das Unternehmen sollte Methoden zur Risikoanalyse implementieren, um potenzielle Probleme frühzeitig zu erkennen. Ein weiterer wichtiger Punkt ist die Dokumentation. Jedes Verfahren, das zur Sicherstellung der Produktqualität beiträgt ist detailliert festzuhalten. Dazu gehören nicht nur die Qualitätskontrollrichtlinien, sondern auch die Vorgehensweisen für die Produktentwicklung und das Risikomanagement. Die Nachverfolgbarkeit von Produkten ist ebenfalls von großer Bedeutung, um im Bedarfsfall nachvollziehen zu können, wie und wo ein Produkt gefertigt wurde.
Risikomanagement spielt eine zentrale Rolle im Rahmen der ISO 13485. Hierbei sollten Unternehmen Prozesse entwickeln, um mögliche Risiken in Bezug auf ihre Produkte zu identifizieren und zu bewerten. Es ist wichtig, potenzielle Gefahren zu erkennen und geeignete Maßnahmen zur Risikominderung festzulegen. Dies erfordert eine umfassende Analyse und ein proaktives Handeln. Die Schulung der Mitarbeiter ist ein weiterer entscheidender Aspekt. Denn damit alle im Unternehmen die Normanforderungen verstehen und umsetzen können, ist es wichtig, regelmäßige Schulungen anzubieten. So bleibt das Wissen stets aktuell, und alle Mitarbeiter sind in der Lage, die Prinzipien der Qualitätssicherung zu leben und anzuwenden. Zudem sollten interne Audits durchgeführt werden, um die Effektivität des Qualitätsmanagementsystems zu überprüfen. Diese Audits helfen, Schwächen zu identifizieren sowie Verbesserungspotenziale aufzuzeigen. Regelmäßige Überprüfungen sind essenziell, um das System an sich ändernde Anforderungen und Vorgaben anzupassen.
Wie ist der Ablauf einer ISO 13485 Zertifizierung?
Der Zertifizierungsprozess nach ISO 13485 umfasst mehrere entscheidende Schritte, die eine strukturierte Herangehensweise an die Qualitätssicherung und das Risikomanagement im Bereich von Medizinprodukten erfordern. Jeder dieser Schritte spielt eine wichtige Rolle, um sicherzustellen, dass alle Anforderungen der Norm eingehalten werden. Und um kontinuierliche Verbesserungen Ihres Qualitätsmanagementsystems zu ermöglichen. Im Folgenden erläutern wir die spezifischen Schritte, die Sie zur ISO 13485-Zertifizierung Ihres Qualitätsmanagementsystems für Medizinprodukte unternehmen müssen:
1. Optionales Voraudit
Ein Voraudit, auch als "Pre-Audit" bekannt, ist eine freiwillige Überprüfung, die vor dem offiziellen Zertifizierungsaudit nach ISO 13485 durchgeführt werden kann. Dieser Schritt unterstützt Unternehmen dabei, ihr Qualitätsmanagementsystem (QMS) zu optimieren und potenzielle Schwachstellen frühzeitig zu identifizieren. Durch das Voraudit können Unternehmen sicherstellen, dass sie gut auf die Anforderungen der ISO 13485 vorbereitet sind. Ein erfahrener Auditor, der mit den Vorgaben der ISO 13485 vertraut ist, analysiert die bestehenden Prozesse, Dokumentationen und Abläufe im Unternehmen. Dabei wird besonderes Augenmerk auf kritische Bereiche wie Qualitätssicherung, Risikomanagement und Mitarbeiterschulungen gelegt. Diese umfassende Analyse hilft, sicherzustellen, dass das QMS den Normanforderungen entspricht.
Ein großer Vorteil des Voraudits liegt darin, dass identifizierte Schwachstellen rechtzeitig behoben werden können. Denn der Auditor gibt klare Empfehlungen zur Optimierung, die umgesetzt werden sollten, bevor das Hauptaudit stattfindet. Ein detaillierter Bericht dokumentiert die Ergebnisse des Voraudits und enthält konkrete Handlungsempfehlungen, was die interne Kommunikation und das Verständnis für notwendige Verbesserungen fördert. Das Voraudit bietet zudem die Möglichkeit, die Mitarbeiter auf die Herausforderungen des bevorstehenden Audits vorzubereiten. Schulungen und Workshops helfen, das Wissen über die ISO 13485 Norm zu vertiefen und das Qualitätsbewusstsein im Team zu stärken.
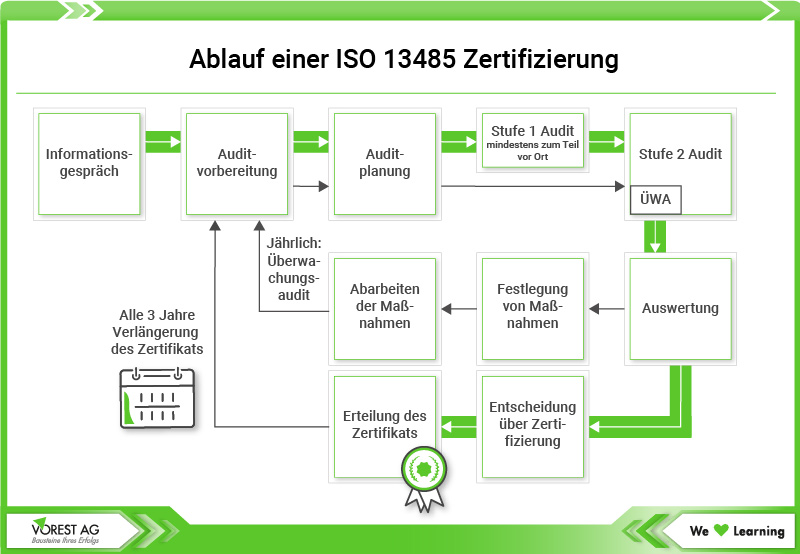
2. Zertifizierungsaudit Stufe I
In der ersten Stufe des Zertifizierungsaudits, bekannt als Stufe I, wird Ihr Qualitätsmanagementsystem für Medizinprodukte daraufhin überprüft, ob es den Anforderungen der ISO 13485 entspricht. In diesem Schritt untersucht der Auditor, wie gut Ihre internen Richtlinien und Verfahren dokumentiert sind und ob sie den Normvorgaben gerecht werden. Der Auditor analysiert Ihre Dokumentation, einschließlich Qualitätshandbüchern sowie Verfahrensanweisungen, um die Struktur und Reife Ihres QMS zu bewerten. Ziel ist es, sicherzustellen, dass alle relevanten Prozesse ordnungsgemäß erfasst sind. Besonders wichtig ist auch die Nachverfolgbarkeit von Entscheidungen und Änderungen. Damit jeder Mitarbeiter die nötigen Informationen hat, um seine Aufgaben richtig zu erledigen.
Die Ergebnisse dieser ersten Auditstufe zur ISO 13485 Zertifizierung werden in einem detaillierten Bericht festgehalten. Dieser Bericht dokumentiert sowohl positive Aspekte als auch Bereiche, in denen Verbesserungen nötig sind, und gibt Ihnen konkrete Empfehlungen zur Behebung festgestellter Schwachstellen. Insgesamt bildet das Zertifizierungsaudit Stufe I die Basis für das weitere Vorgehen im Zertifizierungsprozess. Es gibt Ihnen die Möglichkeit, Ihre Dokumentation und Prozesse zu überarbeiten, bevor das eigentliche Zertifizierungsaudit Stufe II ansteht. Mit einer guten Vorbereitung in dieser Phase erhöhen Sie die Chancen auf einen erfolgreichen Abschluss des gesamten Zertifizierungsprozesses erheblich.
Interessante Produkte für Sie
Kursformen
Zertifikat
Informationen
3. Zertifizierungsaudit Stufe II
Im zweiten Schritt des Zertifizierungsprozesses, dem sogenannten Zertifizierungsaudit Stufe II, steht die praktische Umsetzung Ihrer Qualitätsmanagementsysteme (QMS) im Fokus. Hier wird nicht nur überprüft, ob Ihre dokumentierten Prozesse existieren, sondern auch, wie gut sie im täglichen Geschäft angewendet werden. Der Auditor begibt sich direkt in Ihre Produktionsstätten, um zu beobachten, wie die Abläufe tatsächlich funktionieren. Dabei wird bewertet, ob die festgelegten Richtlinien und Verfahren eingehalten werden und ob die Anforderungen der ISO 13485 in der Praxis umgesetzt sind. Ein wichtiger Bestandteil dieses Audits ist die Überprüfung der Arbeitsweise Ihrer Mitarbeiter. Der Auditor führt Gespräche mit den Angestellten, um deren Verständnis der Prozesse zu prüfen und sicherzustellen, dass sie die Normanforderungen kennen und umsetzen können.
Ein zentraler Aspekt dieser Auditstufe ist die Effektivität Ihres QMS. Der Auditor wird analysieren, ob die festgelegten Maßnahmen zur Qualitätssicherung und Risikominderung tatsächlich wirken und ob die Mitarbeiter entsprechend geschult sind, um die Normanforderungen zu erfüllen. Diese praktische Überprüfung zeigt, ob Ihr Unternehmen in der Lage ist, die hohen Standards der ISO 13485 im Alltag zu halten. Wenn das Audit erfolgreich verläuft und alle Anforderungen erfüllt sind, erhalten Sie schließlich das ISO 13485 Zertifikat. Dieses Zertifikat ist nicht nur ein offizieller Nachweis für die Einhaltung der Norm, sondern stärkt auch das Vertrauen Ihrer Kunden und hebt Ihre Marktposition.
4. Das Nachaudit
Ein Nachaudit oder Überwachungsaudit erfolgt in der Regel ein Jahr nach der Erstzertifizierung. Dabei überprüft der Auditor, ob das QM-System weiterhin den Anforderungen entspricht und ob mögliche Abweichungen aus dem Zertifizierungsaudit behoben wurden. Regelmäßige Nachaudits sichern daher den langfristigen Erhalt der ISO 13485 Zertifizierung.
Und wie lang ist das ISO 13485 Zertifikat gültig?
Ein ISO 13485 Zertifikat ist in der Regel für drei Jahre gültig. Während dieser Zeit müssen jährliche Überwachungsaudits durchgeführt werden, um sicherzustellen, dass das Qualitätsmanagementsystem weiterhin den Anforderungen der Norm entspricht. Nach Ablauf der drei Jahre ist eine Rezertifizierung erforderlich, bei der das komplette Auditverfahren erneut zu durchlaufen ist, um die fortwährende Konformität zu gewährleisten.
Video: Was ist die ISO 13485?
Alle unsere YouTube Videos finden Sie hier auf dem YouTube Kanal der VOREST AG!
Was kostet eine ISO 13485 Zertifizierung?
Die Kosten für eine ISO 13485 Zertifizierung können sehr unterschiedlich ausfallen und hängen von verschiedenen Faktoren ab. Dazu gehören vor allem die Größe und Komplexität Ihres Unternehmens sowie der aktuelle Zustand Ihres Qualitätsmanagementsystems. Ein wesentlicher Teil der Kosten sind die Ausgaben für Vorbereitung und Beratung. Viele Unternehmen entscheiden sich, externe Berater hinzuzuziehen, um sicherzustellen, dass alle Anforderungen der Norm ordnungsgemäß umgesetzt werden. Diese Beratung kann je nach Umfang und Dauer mehrere tausend Euro kosten. Zusätzlich ist es wichtig, in Schulungen für Ihre Mitarbeiter zu investieren, damit alle die notwendigen Kenntnisse zur ISO 13485 Norm erwerben. Auch diese Schulungsmaßnahmen können mit erheblichen Kosten verbunden sein.
Ein weiterer wichtiger Punkt sind die Zertifizierungsaudits, die von akkreditierten Zertifizierungsstellen durchgeführt werden. Diese Gebühren variieren je nach Unternehmensgröße und Komplexität und können ebenfalls von mehreren tausend bis hin zu fünfstelligen Beträgen reichen. Aber das ist noch nicht alles: Nach der Erstzertifizierung müssen Unternehmen auch Nachfolgekosten einkalkulieren. Jährliche Überwachungsaudits sind notwendig, um sicherzustellen, dass Ihr Qualitätsmanagementsystem den Anforderungen weiterhin entspricht. Zudem müssen Sie alle drei Jahre mit Kosten für die Rezertifizierung rechnen. Insgesamt sollten Unternehmen berücksichtigen, dass die ISO 13485 Zertifizierung nicht nur eine einmalige Investition erfordert, sondern auch eine langfristige Planung und Budgetierung.
In welchen Bereichen findet die Zertifizierung gemäß ISO 13485 Anwendung?
Sie ist vor allem auf die spezifischen Anforderungen der Medizintechnikbranche ausgelegt und findet in einer Vielzahl von Bereichen Anwendung, die mit der Herstellung und dem Vertrieb von Medizinprodukten zu tun haben. Hier sind einige der wichtigsten Bereiche, in denen die Norm von Bedeutung ist:
- Hersteller von Medizinprodukten: Diese Kategorie umfasst Unternehmen, die eine Vielzahl von medizinischen Geräten herstellen. Dazu zählen chirurgische Instrumente, Implantate und diagnostische Geräte. Für diese Hersteller ist es entscheidend, dass ihre Produkte nicht nur sicher, sondern auch wirksam sind. Die Einhaltung der ISO 13485 Norm ermöglicht es ihnen, Vertrauen bei ihren Kunden aufzubauen. Zudem erfüllen Sie so die gesetzlichen Anforderungen, die für die Zulassung ihrer Produkte notwendig sind.
- Zulieferer und Dienstleister: Auch Unternehmen, die Komponenten oder Dienstleistungen für die Hersteller von Medizinprodukten bereitstellen, profitieren von der ISO 13485 Zertifizierung. Dazu zählen beispielsweise Anbieter von Verpackungen, Sterilisationsdiensten oder Laboruntersuchungen. Diese Zulieferer müssen sicherstellen, dass ihre Produkte und Dienstleistungen die hohen Anforderungen der Medizintechnik erfüllen.
- Vertrieb von Medizinprodukten: Unternehmen, die Medizinprodukte importieren, vertreiben oder in den Markt bringen, sind ein weiterer wichtiger Anwendungsbereich für die ISO 13485. Diese Firmen tragen oft die Verantwortung für die Qualitätssicherung sowie die Einhaltung von Vorschriften beim Vertrieb medizinischer Produkte. Durch die Implementierung eines Qualitätsmanagementsystems gemäß ISO 13485 können sie sicherstellen, dass die Produkte, die sie vertreiben, den erforderlichen Standards entsprechen und somit die Sicherheit der Endverbraucher gewährleisten.
- Software-Entwickler im Gesundheitswesen: Ein zunehmend wichtiger Bereich ist die Entwicklung von Software für medizinische Anwendungen. Anbieter, die Software für bildgebende Verfahren, elektronische Gesundheitsakten oder andere medizinische Anwendungen entwickeln, können ebenfalls von der ISO 13485 profitieren. Die Norm hilft diesen Unternehmen, die Qualität und Sicherheit ihrer Softwarelösungen sicherzustellen, was besonders wichtig ist. Da Fehler in der Software im Gesundheitswesen gravierende Folgen haben können.
Kostenlose Vorlage -
Erstellung einer Prozessbeschreibung

Kostenlose Vorlage -
Erstellung einer Arbeitsanweisung

Kostenloser E-Kurs -
Was ist ein Audit?

Unsere Serviceangebote im Bereich Qualitätsmanagement Medizinprodukte
- Grundlagenwissen zum Thema: Qualitätsmanagement Medizinprodukte ISO 13485 – Definition & Ziele
- Ausbildungen & Weiterbildungen: ISO 13485 Schulung - Qualitätsmanagement Medizinprodukte
- E-Learning Kurse: Medizinprodukte Online Schulungen & ISO 13485 E-Learning
- Inhouse-Training: Qualitätsmanagement Medizinprodukte Inhouse Schulungen bei Ihnen im Unternehmen
- Musterdokumente: Qualitätsmanagement Medizinprodukte Vorlagen und Checklisten
- Wissensbausteine: Expertenwissen zum Qualitätsmanagement Medizinprodukte
- Fachzeitschrift PRO SYS: Monatliche Fachinfos inklusive Musterdokumente
- Beratung: Wir unterstützen Sie beratend zum Qualitätsmanagement Medizinprodukte

Ich helfe Ihnen gerne weiter!
Kati Schäfer
Produktmanagement Training & PRO SYS
Tel.: 07231 92 23 91 - 0
E-Mail: kschaefer@vorest-ag.de








